Theo tin từ Cục Quản lý dược (Bộ Y tế) ngày 4-1, trong tuần này, Hội đồng Tư vấn cấp giấy phép thuốc và nguyên liệu làm thuốc của Bộ Y tế sẽ họp nhằm xem xét cấp số đăng ký cho 4 loại thuốc chứa hoạt chất Molnupiravir cho 4 công ty dược trong nước.
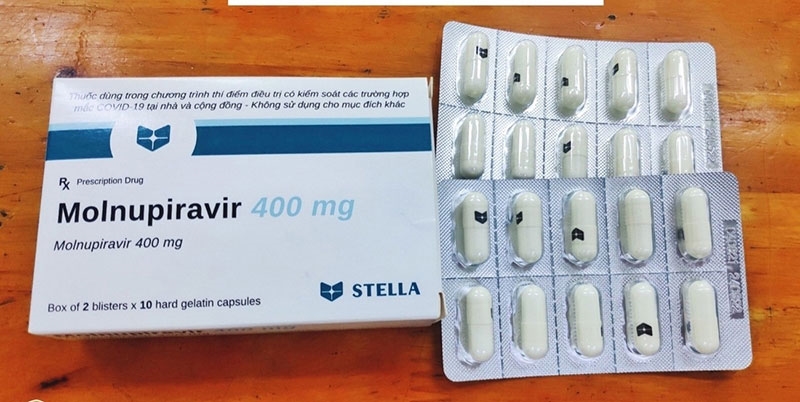
Thuốc Molnupiravir cho chương trình thí điểm điều trị có kiểm soát các trường hợp mắc Covid-19 thể nhẹ.
Molnupiravir là một thuốc kháng vi rút, hiện chưa được cấp phép lưu hành tại Việt Nam. Việc sử dụng thuốc Molnupiravir tại nước ta được tiến hành thông qua hình thức nghiên cứu tại cộng đồng trong khuôn khổ chương trình thí điểm điều trị có kiểm soát chặt chẽ.
Trong phác đồ điều trị Covid-19 ở nước ta, Molnupiravir cùng với Favipiravir, Remdesivir là 3 loại thuốc kháng vi rút đã được Bộ Y tế đưa vào sử dụng. Riêng Molnupiravir và Favipiravir là hai loại thuốc kháng vi rút dạng viên, dùng theo đường uống, dễ dàng sử dụng cho F0 điều trị tại nhà. Trong khi đó, Remdesivir là thuốc tiêm bắp, dùng cho bệnh nhân nặng, nên chỉ sử dụng trong bệnh viện.
Vào tháng 8-2021, Bộ Y tế đã cho phép triển khai chương trình sử dụng thuốc có kiểm soát Molnupiravir cho các trường hợp mắc Covid-19 thể nhẹ tại cộng đồng ở thành phố Hồ Chí Minh. Mới đây, Bộ Y tế đã công bố kết quả thử nghiệm Molnupiravir, ghi nhận gần 100% bệnh nhân dùng thuốc có tải lượng vi rút thấp, tỷ lệ chuyển nặng rất thấp, không có ca tử vong. Hiện chương trình sử dụng thuốc có kiểm soát Molnupiravir cho các trường hợp mắc Covid-19 thể nhẹ tại cộng đồng đã mở rộng triển khai tại 51 tỉnh, thành phố có dịch trên toàn quốc.
Cũng theo Bộ Y tế, đã có 10 đơn vị nộp hồ sơ đề nghị cấp số đăng ký cho thuốc chứa hoạt chất Molnupiravir trong nước. Ngày 4-1, theo tin từ Cục Quản lý dược (Bộ Y tế), trong tuần này, Hội đồng Tư vấn cấp giấy phép thuốc và nguyên liệu làm thuốc của Bộ Y tế sẽ họp nhằm xem xét cấp số đăng ký cho 4 loại thuốc chứa hoạt chất Molnupiravir cho 4 công ty dược trong nước, 6 đơn vị còn lại đang bổ sung hồ sơ để xem xét cấp vào đợt sau.
Trong 4 công ty dược nêu trên, Công ty cổ phần hóa - dược phẩm Mekophar - một trong những doanh nghiệp dược đầu tiên của Việt Nam đạt tiêu chuẩn GMP-WHO (tiêu chuẩn thực hành tốt sản xuất thuốc) đủ nguyên liệu để bào chế 4.750.000 viên nén chứa hoạt chất Molnupiravir.
Trước đó, ngày 30-12-2021, Ủy ban Thường vụ Quốc hội ban hành Nghị quyết số 12/2021/UBTVQH15 về việc cho phép thực hiện một số cơ chế, chính sách trong lĩnh vực y tế để phục vụ công tác phòng, chống dịch Covid-19. Theo đó, Nghị quyết này đã đề cập đến việc quản lý thuốc, nguyên liệu làm thuốc trong bối cảnh dịch Covid-19, trong đó giao cho Bộ trưởng Bộ Y tế xem xét quyết định việc sử dụng dược chất đã được cấp phép nhập khẩu để sản xuất thuốc.
Việc cấp giấy đăng ký lưu hành đối với các thuốc mới có chỉ định điều trị Covid-19 nhập khẩu, được cấp phép có điều kiện tại một trong số cơ quan quản lý dược chặt chẽ (SRA) (do Tổ chức Y tế thế giới (WHO) công bố) được thực hiện trong 10 ngày, kể từ ngày nhận đủ hồ sơ theo quy định. Ngoài ra, các thuốc mới có chỉ định điều trị Covid-19 sản xuất trong nước nếu có cùng dạng bào chế, đường dùng, hàm lượng với thuốc đã được SRA cấp phép thì Việt Nam cho phép miễn nộp hồ sơ nghiên cứu lâm sàng trong hồ sơ đề nghị cấp giấy đăng ký lưu hành.
Quy định mới này sẽ mở ra cơ hội cho các công ty dược trong nước sản xuất thuốc mới điều trị Covid-19, trong đó có Molnupiravir.







Gửi phản hồi
In bài viết